Вовремя диагностированный инфаркт миокарда – залог хороших результатов лечения и прогнозов заболевания. Не только пациент, но и в первую очередь специалист, заинтересованы в том, чтобы заболевание не было распознано, а лечение начато незамедлительно.

Диагностика инфаркта миокарда — это такой момент, к которому должны подойти ответственно обе стороны. Лечащему врачу необходимо внимательно соблюдать все диагностические моменты, а пациенту — дать ему как можно больше информации о состоянии своего здоровья.
Не стоит игнорировать на первый взгляд незначимыми симптомами. Как раз-таки они могут заставить врача заподозрить атипично протекающий инфаркт миокарда.
- 1 Основные этапы диагностики инфаркта миокарда
- 2 Жалобы пациента
- 3 Электрокардиографическое исследование — ЭКГ
- 4 Лабораторная диагностика
- 5 Определение кардиоспецифических маркеров
- 6 Общий и биохимический анализы крови
- 7 Эхокардиография или УЗИ сердца – метод, играющий важную роль в диагностике ИМ
- 8 Другие методы исследования
- Причины инфаркта
- Факторы риска инфаркта миокарда:
- Механизм развития инфаркта миокарда
- Классификация инфаркта миокарда
- Симптомы инфаркта миокарда
- Признаки типичной формы инфаркта миокарда
- Признаки атипичных форм инфаркта миокарда
- Осложнения и последствия инфаркта миокарда
- Диагностика инфаркта миокарда
- Лабораторная диагностика
- Инструментальная диагностика
- Лечение инфаркта миокарда
- Инфаркт миокарда : Лабораторные исследования
- Инфаркт миокарда : Сывороточные ферменты
1 Основные этапы диагностики инфаркта миокарда
В диагностике инфаркта существует 4 группы диагностических методов, благодаря которым заболевание может быть выявлено.
2 Жалобы пациента

Это один из самых важных моментов, на которые стоит обратить внимание. Для болевого приступа при инфаркте миокарда характерно изменение симптомов, которые наблюдались у пациента при стенокардии.
- Боль — она принимает колющий, режущий, жгучий характер.
- Ее интенсивность превышает такую при обычном приступе стенокардии, а продолжительность составляет более 15-20 минут.
- Зона распространения боли шире, чем при обычном приступе стенокардии. Боли могут отдавать не только в левую половину грудной клетки, но и распростаняться на правые ее отделы.
- Характерна волнообразность болевых ощущений.
- Приступ не проходит после приема нитроглицерина.

Болевой приступ могут сопровождать следующие новые симптомы:
- одышка
- головокружение
- нарушение ритма сердца
- выраженная общая слабость, потливость
- сердцебиение, ощущение перебоев в работе сердца
- чувство страха смерти, возбуждение
- тошнота, рвота
- повышение артериального давления
- повышение температуры тела
Однако следует учитывать, что болевой приступ может быть нетипичным, локализоваться в области желудка, в левом плече или запястье по типу «браслета». Сам характер болей может быть неинтенсивным. Такой вариант приступа может наблюдаться у пожилых людей, при сахарном диабете, при повторном инфаркте.
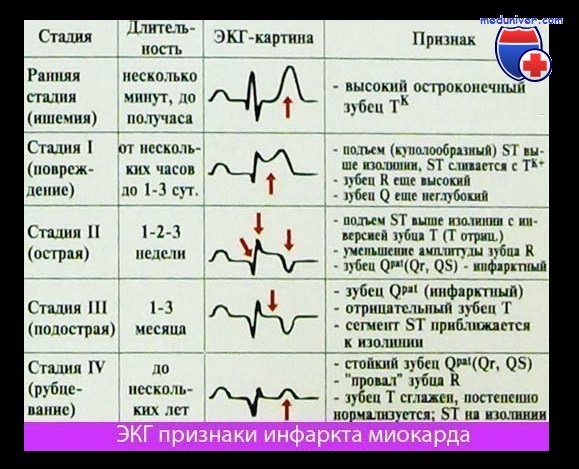
3 Электрокардиографическое исследование — ЭКГ

ЭКГ — доступный метод диагностики, который позволяет выявить повреждение сердечной мышцы и определиться с тактикой лечения. ЭКГ при инфаркте всегда смотрится в динамике, т.е. это исследование повторяется через определенные промежутки времени с целью оценки течения заболевания. Метод позволяет оценить распространенность повреждения, выявить осложнения инфаркта в виде различных нарушений ритма, формирования аневризмы сердца.
4 Лабораторная диагностика
Лабораторная диагностика инфаркта миокарда включает исследование крови на маркеры инфаркта миокарда, а также общий и биохимический анализы крови. Диагностика инфаркта с целью определения ферментов является обязательной и важной в постановке диагноза.
Подробности про анализы крови, можно найти на сайте Гид по Анализам ( GidAnaliz.ru )
5 Определение кардиоспецифических маркеров

Исследование активности ферментов
Диагностика инфаркта методом определения кардиоспецифических маркеров получила в последнее время широкое распространение. Кардиоспецифичными эти вещества называются потому, что они входят в состав сердечной мышцы. Поэтому при ее разрушении наблюдается выход их в кровь. К специфическим ферментам сердечной мышцы относятся следующие соединения:
- Тропонины Т и I
- Миоглобин
- Креатинфосфокиназа-МВ (КФК-МВ)
- Лактатдегидрогеназа-1 (ЛДГ-1)
- АСТ
Анализы (тесты) на кардиоспецифические маркеры являются обязательными в диагностике инфаркта миокарда. В настоящее время применяются следующие лабораторные тесты:

Тест на тропонин
1. Тропониновый тест
В последнее время особое внимание уделяется именно этому тесту. Этот тест наиболее чувствительный в диагностике острого инфаркта, хотя его уровень может повышаться и при других патологических процессах в организме. Повышение уровня ферментов наблюдается через 3-4 часа от начала приступа и достигает максимальных величин к 2-м суткам. Повышенный уровень тропонинов держится до 10 (I) и 15 (Т) суток.
Уровень концентрации отражает размеры очага некроза. Чем обширнее инфаркт, тем выше содержание этих веществ в крови. Эти вещества могут иметь разные показатели нормы в зависимости от реактива, который используется в лаборатории.
2. Миоглобиновый тест — определение содержания миоглобина. Фермент начинает повышаться через 2-3 часа и достигает максимальной концентрации к 10-му часу от начала инфаркта. Повышенный уровень этого фермента может наблюдаться до 3 суток. Уровень миоглобина может повышаться в 10-20 раз в сравнении с нормой.
Нормальным содержанием миоглобина в крови у мужчин считается 22-66 мкг/л, у женщин — 21-49 мкг/л или 50-85 нг/мл.

3. Креатинфосфокиназный тест (КФК-МВ-тест) — определение МВ фракции этого фермента в крови. Повышение уровня фермента наблюдается через 4-8 часов от начала приступа и достигает максимума к 24-му часу. Уже к 3 суткам уровень возвращается к исходному.
Нормальные показатели МВ-КФК составляют 0-24 МЕ/л или 6% от общей активности КФК
4. Лактатдегидрогеназный тест — определение содержания в крови ЛДГ-1. Он начинает повышаться через 8 часов и достигает максимума на 2-3 сутки. Повышенный уровень фермента держится до 12 суток.
Содержание общей ЛДГ в крови в норме 240-480 МЕ/л, при этом ЛДГ-1 составляет 15-25% от общей активности ЛДГ
5. Аспартатаминотрансферазный тест (АСТ-тест). АСТ — фермент, который кроме миокарда, содержится и в других органах и тканях организма. Поэтому он не совсем является кардиоспецифичным. Однако его концентрация может быть определена с помощью биохимического анализа крови. При ИМ его уровень повышается через 6-8 часов, достигая макимальных значений к 36 часу. На таком повышенном уровне фермент может держаться до 6 дней. Его содержание в крови при остром инфаркте повышается в 5-20 раз.
В норме содержание АСТ в крови составляет 0,1-0,45 мкмоль/(ч*мл) или 28-190 нмоль/(с*л)
6 Общий и биохимический анализы крови

Общий и биохимический анализы дополняют диагностику инфаркта миокарда, подтверждая наличие в организме воспалительных процессов.
- Общий анализ крови:
- через 3-4 часа повышается содержание лейкоцитов, которое в таких значениях может сохраняться до недели. Количество лейкоцитов может достигать 12-15х109/л
- увеличение СОЭ наблюдается со 2-3 дня и достигает максимальных значений к концу 2-й недели. Затем постепенно этот показатель снижается, и через 3-4 недели уровень его возвращается к исходному
- Биохимический анализ крови:
- Повышаются показатели белков «острой фазы», отражающие наличие воспалительного процесса в организме: фибриногена, серомукоида, гаптоглобина, сиаловых кислот,а2-глобулина, гамма-глобулина, С-реактивного белка.
Общий и биохимический анализы крови не являются ведущими в постановке диагноза, однако они учитываются в отношении прогноза заболевания и качества проводимой терапии.
7 Эхокардиография или УЗИ сердца – метод, играющий важную роль в диагностике ИМ

Благодаря этому исследованию можно выявить нарушение сократимости сердечной мышцы в определенном участке, определиться с локализацией инфаркта. Этот метод также помогает отличить инфаркт от других неотложных состояний, которые проявляются подобными симптомами, но тактика ведения таких пациентов совсем другая.
Итак, жалобы пациента, результаты ЭКГ в динамике, УЗИ сердца, анализы на кардиомаркеры — основные составляющие в постановке диагноза острого инфаркта.
8 Другие методы исследования
Кроме этих основных исследований в диагностике инфаркта миокарда используются и другие дополнительные методы исследования:
- Сцинтиграфия миокарда — метод диагностики, при котором в организм поступает радиоизотопное вещество. Оно имеет свойство накапливаться в зоне повреждения.
- Позитронная эмиссионная томография — дополнительный метод диагностики, выявляющий участки сниженного кровоснабжения миокарда.
- Магниторезонансная томография позволяет оценить состояние сердечной мышцы на наличие гипертрофии, участков недостаточного кровоснабжения.
- Компьютерная томография — метод рентгенологической диагностики, с помощью которого оцениваются размеры сердца, его камер, наличие гипертрофии и тромбов.

Инфаркт миокарда (ИМ) – самая серьезная клиническая форма ишемии сердца. Это острое, угрожающее жизни, состояние, обусловленное относительным либо абсолютным недостатком кровоснабжения определенной части миокарда вследствие тромбоза коронарной артерии, в результате чего формируется очаг некроза, т.е. область с отмершими клетками – кардиомиоцитами.
Инфаркт сердца – одна из ведущих причин смертности населения планеты. Его развитие напрямую зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом. До 20% внезапных смертей вызваны этой патологией.
Причины инфаркта
Главные причины развития ИМ:
- Атеросклероз сосудов сердца, в частности коронарных артерий. В 97% случаев атеросклеротическое поражение стенок сосудов приводит к развитию ишемии миокарда с критическим сужением просвета артерий и длительным нарушением кровоснабжения миокарда.
- Тромбоз сосудов, к примеру, при коронарите различного генеза. Полное прекращение кровоснабжения мышцы происходит вследствие обтурации (закупорки) артерий или мелких сосудов атеросклеротической бляшкой или тромбом.
- Эмболиявенечных артерий, например, при септическом эндокардите, реже заканчивается образованием некротического очага, тем не менее являясь одной из причин формирования острой ишемии миокарда.
Нередко встречается сочетание вышеперечисленных факторов: тромб закупоривает спастически суженный просвет артерии, пораженной атеросклерозом или формируется в области атеросклеротической бляшки, выпяченной из-за произошедшего кровоизлияния в ее основание.
- Пороки сердца. Коронарные артерии могут отходит от аорты вследствие формирования органического поражения сердца.
- Хирургическая обтурация. Механическое вскрытие артерии или ее перевязка во время проведения ангиопластики.
Факторы риска инфаркта миокарда:
- Пол (у мужчин чаще).
- Возраст (после 40–65 лет).
- Стенокардия.
- Порок сердца.
- Ожирение.
- Сильный стресс или физическое перенапряжение при имеющейся ИБС и атеросклерозе.
- Сахарный диабет.
- Дислипопротеинемия, чаще гиперлипопротеинемия.
- Курение и прием алкоголя.
- Гиподинамия.
- Артериальная гипертония.
- Ревмокардит, эндокардит или другие воспалительные поражения сердца.
- Аномалии развития коронарных сосудов.
Механизм развития инфаркта миокарда
Течение болезни делится на 5 периодов:
- Прединфарктный (стенокардия).
- Острейший (острая ишемия сосудов сердца).
- Острый (некробиоз с формированием некротической области).
- Подострый (стадия организации).
- Постинфарктный (образование рубца в месте некроза).
Последовательность патогенетических изменений:
- Нарушение целостности атеросклеротического отложения.
- Тромбоз сосуда.
- Рефлекторный спазм поврежденного сосуда.
При атеросклерозе избыточный холестерин откладывается на стенках сосудов сердца, на которых образуются липидные бляшки. Они сужают просвет пораженного сосуда, замедляя кровоток по нему. Различные провоцирующие факторы, будь то гипертонический криз или эмоциональное перенапряжение, приводят к разрыву атеросклеротического отложения и повреждению сосудистой стенки. Нарушение целостности внутреннего слоя артерии активирует защитный механизм в виде свертывающей системы организма. К месту разрыва прилипают тромбоциты, из которых формируется тромб, закупоривающий просвет сосуда. Тромбоз сопровождается выработкой веществ, приводящих к спазмированию сосуда в области повреждения либо по всей его длине.
Клиническое значение имеет сужение артерии на 70% размера ее диаметра, при этом просвет спазмируется до такой степени, что кровоснабжение не может быть компенсировано. Это возникает вследствие атеросклеротических отложений на стенки сосудов и ангиоспазма. В результате нарушается гемодинамика области мышцы, получающей кровь через поврежденное сосудистое русло. При некробиозе страдают кардиомиоциты, недополучая кислород и питательные вещества. Нарушается метаболизм и функционирование сердечной мышцы, ее клетки начинают отмирать. Период некробиоза длится до 7 часов. При незамедлительно оказанной в этот промежуток времени медицинской помощи происходящие изменения в мышце могут быть обратимы.
При формировании некроза в пораженной области восстановить клетки и повернуть процесс вспять невозможно, повреждения приобретают необратимый характер. Страдает сократительная функция миокарда, т.к. некротизированная ткань не участвует в сокращении сердца. Чем обширнее область поражения, тем сильнее снижается сократимость миокарда.
Единичные кардиомиоциты или небольшие их группы гибнут спустя примерно 12 часов от начала острого заболевания. Через сутки микроскопически подтверждается массовое омертвление клеток сердца в зоне поражения. Замещение области некроза соединительной тканью начинается через 7–14 дней от начала инфаркта. Постинфарктный период продолжается 1,5–2 месяца, в течение которых окончательно формируется рубец.
Передняя стенка левого желудочка – наиболее частое место локализации некротической зоны, поэтому в большинстве случаев выявляется трансмуральный ИМ именно этой стенки. Реже поражается верхушечная область, задняя стенка или межжелудочковая перегородка. Инфаркты правого желудочка в кардиологической практике встречаются редко.
Классификация инфаркта миокарда
Относительно размера поражения ткани инфаркт миокарда бывает:
- Мелкоочаговый. Формируется один или несколько маленьких по размеру некротических участков. Диагностируется в 20% случаев от общего числа инфарктников. У 30% пациентов мелкоочаговый инфаркт трансформируется в крупноочаговый.
- Крупноочаговый (чаще трансмуральный). Образуется обширная область некроза.
По глубине некротического поражения различают:
- Трансмуральный. Некротическая область охватывает всю толщу миокарда.
- Субэпикардиальный. Участок с отмершими кардиомиоцитами прилегает к эпикарду.
- Субэндокардиальный. Некроз сердечной мышца в районе прилегания к эндокарду.
- Интрамуральный. Участок некроза находится в толще левого желудочка, но не доходит до эпикарда или эндокарда.
В зависимости от кратности возникновения:
- Первичный. Возникает первый раз.
- Повторный. Развивается через 2 месяца или позже после начала первичного.
- Рецидивирующий. Появляется на стадии формирования рубцовой ткани первичного инфаркта, т.е. в течение первых 2 мес. от первичного острого поражения миокарда.
Относительно локализации процесса:
- Левожелудочковый.
- Правожелудочковый.
- Септальный, или инфаркт межжелудочковой перегородки.
- Сочетанный, к примеру переднебоковой ИМ.
Отталкиваясь от электрокардиологических изменений, фиксируемых на кардиограмме:
- Q-инфаркт. Электрокардиограмма фиксирует сформировавшийся патологический з. Q или желудочковый комплекс QS. Изменения характерны для крупноочаговых ИМ.
- Не Q-инфаркт с инверсией з. Т и без патологии з. Q. Чаще встречается при мелкоочаговых инфарктах.
В зависимости от развития осложнений:
Формы острого ИМ, относительно наличия и места расположения болей:
- Типичная. Боль сосредоточена в прекардиальной либо загрудинной области.
- Атипичная. Форма заболевания с атипичной локализацией болей:
Симптомы инфаркта миокарда
Интенсивность и характер болевых ощущений зависят от нескольких факторов: размера и локализации некротического очага, а также стадии и формы инфаркта. У каждого пациента клинические проявления различны в силу индивидуальных особенностей и состояния сосудистой системы.
Признаки типичной формы инфаркта миокарда
Яркая клиническая картина с типичным и выраженным болевым синдромом наблюдается при крупноочаговом (трансмуральном) инфаркте сердца. Течение болезни разделяю на определенные периоды:
- Прединфарктный, или продромальный период. У 43–45% инфарктников этот период отсутствует, т.к. болезнь начинается внезапно. Большинство пациентов перед инфарктом отмечают учащение приступов стенокардии, загрудинные боли становятся интенсивными и продолжительными. Изменяется общее состояние – снижается настроение, появляется разбитость и страх. Эффективность антиангинальных средств значительно снижается.
- Острейший период (от 30 мин до нескольких часов). При типичной форме острый инфаркт сопровождается нестерпимой загрудинной болью с иррадиацией в левую сторону туловища – руку, нижнюю челюсть, ключицу, предплечье, плечо, область между лопатками. Редко под лопатку или левое бедро. Боли могут быть жгучими, режущими, давящими. Некоторые ощущают распирание в груди или ломоту. В течение нескольких минут боль достигает своего максимума, после чего сохраняется до часа и дольше, то усиливаясь, то ослабевая.
- Острый период (до 2 суток, при рецидивирующем течении до 10 дней и дольше). У подавляющего большинства больных ангинозная боль проходит. Ее сохранение свидетельствует о присоединении эпистеноперикардиального перикардита либо о продолжительном течении ИМ. Нарушения проводимости и ритма сохраняются, также как и артериальная гипотензия.
- Подострый период (длительность – 1 мес). Общее состояние пациентов улучшается: температура нормализуется, проходит одышка. Полностью или частично восстанавливается сердечный ритм, проводимость, звучность тонов, но блокада сердца регрессу не поддается.
- Постинфарктный период – завершающий этап течения острого ИМ, длящийся до 6 месяцев. Некротическая ткань окончательно заменяется плотным рубцом. Сердечная недостаточность устраняется за счет компенсаторной гипертрофии сохранившегося миокарда, но при обширной площади поражения полная компенсация невозможна. В этом случае проявления сердечной недостаточности прогрессируют.
Начало боли сопровождается сильной слабостью, появлением обильного липкого (профузного) пота, чувством страха смерти, учащением сердцебиения. При физикальном обследовании выявляется бледность кожи, липкий пот, тахикардия и другие нарушения ритма (экстрасистолия, фибрилляция предсердий), возбуждение, одышка в покое. В первые минуты повышается артериальное давление, потом резко понижается, что свидетельствует о развивающейся недостаточности сердца и кардиогенном шоке.
При тяжелом течении развивается отек легких, иногда сердечная астма. Тоны сердца при аускультации приглушены. Появление ритма галопа говорит о левожелудочковой недостаточности, от степени выраженности которой зависит аускультативная картина легких. Жесткое дыхание, хрипы (влажные) подтверждают застой крови в легких.
Ангинозная боль в этом периоде нитратами не купируется.
В результате перифокального воспаления и некроза появляется лихорадка, сохраняющаяся на протяжении всего периода. Температура поднимается до 38,5 0 С, высота ее подъема зависит от размера некротического очага.
При мелкоочаговом инфаркте мышцы сердца симптоматика менее выражена, течение болезни не такое четкое. Редко развивается недостаточность сердца. Аритмия выражается в умеренной тахикардии, которая бывает не у всех больных.
Признаки атипичных форм инфаркта миокарда
Подобные формы характеризуются нетипичной локализацией болей, затрудняющей своевременную установку диагноза.
- Астматическая форма. Характерен кашель, приступы удушья, проливной холодный пот.
- Гастралгическая (абдоминальная) форма проявляется болями в эпигастральной области, рвотой, тошнотой.
- Отечная форма бывает при массивной очаге некроза, приводящем к тотальной сердечной недостаточности с отеками, одышкой.
- Церебральная форма характерна для пожилых пациентов с выраженным атеросклерозом не только сердечных, но и мозговых сосудов. Проявляется клиникой ишемии головного мозга с головокружениями, потерей сознания, шумом в ушах.
- Аритмическая форма. Единственным ее признаком может быть пароксизмальная тахикардия.
- Стертая форма отличается отсутствием жалоб.
- Периферическая форма. Боли могут быть только в руке, подвздошной ямке, нижней челюсти, под лопаткой. Иногда опоясывающая боль схожа с болями, возникающими при межреберной невралгии.
Осложнения и последствия инфаркта миокарда
- Тромбоз в желудочках.
- Острый эрозивный гастрит.
- Острый панкреатит либо колит.
- Парез кишечника.
- Желудочное кровотечение.
- Синдром Дресслера.
- Острая, а в дальнейшем хроническая прогрессирующая недостаточность сердца.
- Кардиогенный шок.
- Постинфарктный синдром.
- Эпистенокардиальный перикардит.
- Тромбоэмболии.
- Аневризма сердца.
- Отек легких.
- Разрыв сердца, приводящий к его тампонаде.
- Аритмии: пароксизмальная тахикардия, экстрасистолия, внутрижелудочковая блокада, фибрилляция желудочков и другие.
- Инфаркт легких.
- Пристеночный тромбоэндокардит.
- Психические и нервные расстройства.
Диагностика инфаркта миокарда
Анамнез болезни, электрокардиографические признаки (изменения на ЭКГ) и характерные сдвиги ферментативной активности в сыворотке крови являются основным критериями при диагностике острого ИМ.
Лабораторная диагностика
В первые 6 часов острого состояния в крови выявляется повышенный уровень белка – миоглобина, участвующего в транспортировке кислорода внутрь кардиомиоцитов. В течение 8–10 часов больше чем на 50% увеличивается креатинфосфокиназа, показатели активности которой нормализуются к концу 2 суток. Этот анализ повторяют каждые 8 часов. Если получают троекратный отрицательный результат, то инфаркт сердца не подтверждается.
На более позднем сроке необходим анализ на определение уровня лактатдегидрогеназы (ЛДГ). Активность этого фермента увеличивается спустя 1–2 суток от начала массового омертвления кардиомиоцитов, по прошествии 1–2 недель приходит в норму. Высокой специфичностью отличается повышение изоформ тропонина, увеличение уровня аминотрансфераз (АСТ, АЛТ). В общем анализе – повышение СОЭ, лейкоцитоз.
Инструментальная диагностика
ЭКГ фиксирует появление отрицательного з. Т либо его двухфазность в определенных отведениях (при мелкоочаговом ИМ), патологии комплекса QRS или з. Q (при крупноочаговом ИМ), а также различные нарушения проводимости, аритмии.
Электрокардиография помогает определить обширность и локализацию области омертвения, оценить сократительную способность сердечной мышцы, выявить осложнения. Рентгенологическое исследование малоинформативно. На поздних этапах проводят коронарографию, выявляющую место, степень сужения или непроходимости коронарной артерии.
Лечение инфаркта миокарда
При подозрении на инфаркт сердца срочно вызывают скорую помощь. До приезда медиков нужно помочь больному принять полусидячее положение с согнутыми в коленях ногами, ослабить галстук, расстегнуть одежду, чтобы она не стягивала грудь и шею. Открыть форточку или окно для доступа свежего воздуха. Под язык положить таблетку аспирина и нитроглицерина, которые предварительно измельчить или попросить больного их разжевать. Это необходимо для более быстрого всасывания действующего вещества и получения скорейшего эффекта. Если ангинозные боли не прошли от одной таблетки нитроглицерина, то его следует рассасывать через каждые 5 минут, но не больше 3 таблеток.
Больной с подозрением на инфаркт сердца подлежит незамедлительной госпитализации в кардиологическую реанимацию. Чем раньше реаниматологи начнут лечение, тем благоприятнее дальнейший прогноз: можно предупредить развитие ИМ, предотвратить появление осложнений, сократить площадь очага некроза.
Основные цели первоочередных лечебных мероприятий:
- снятие болевого синдрома;
- ограничение некротической зоны;
- предотвращение осложнений.
Купирование болевых ощущений – один из важнейших и неотложных этапов лечения ИМ. При неэффективности таблетированного нитроглицерина, его вводят в/в капельно либо наркотический анальгетик (например, морфин) + атропин в/в. В некоторых случаях проводят нейролептанальгезию – в/в нейролептик (дроперидол) + анальгетик (фентанил).
Тромболитическая и антикоагулянтная терапия направлена на сокращение зоны некроза. Впервые сутки от появления первых признаков инфаркта для рассасывания тромба и восстановления кровотока возможно проведение процедуры тромболизиса, но для предотвращения гибели кардиомиоцитов эффективнее ее делать в первые 1–3 часа. Назначают тромболитические препараты – фибринолитики (стрептокиназа, стрептаза), антиагреганты (тромбо-АСС), антикоагулянты (гепарин, варфарин).
Антиаритмическая терапия. Для устранения нарушений ритма, сердечной недостаточности, восстановления метаболизма в ткани сердца применяют антиаритмические препараты (бисопролол, лидокаин, верапамил, атенолол), анаболики (ретаболил), поляризующую смесь и т.д.
Для лечения острой недостаточности сердца используют сердечные гликозиды (коргликон, строфантин), диуретики (фуросемид).
Для устранения психомоторного возбуждения применяют нейролептики, транквилизаторы (седуксен), седативные средства.
Прогноз заболевания зависит от быстроты оказания первой квалифицированной помощи, своевременности проведения реанимационных мероприятий, размера и локализации очага поражения миокарда, наличия либо отсутствия осложнений, возраста пациента и имеющихся у него сопутствующих сердечно-сосудистых патологий.
Во многих случаях у больных доминирует реакция на боль в грудной клетке. Они беспокойны, возбуждены, пытаются снять боль, двигаясь в постели, корчась и вытягиваясь, пытаются вызвать одышку или даже рвоту. Иначе ведут себя больные во время приступа стенокардии. Они стремятся занять неподвижное положение из-за боязни возобновления болей. Часто наблюдаются бледность, потливость и похолодание конечностей. Загрудинные боли, продолжающиеся более 30 мин, и наблюдаемая при этом потливость свидетельствуют о высокой вероятности острого инфаркта миокарда. Несмотря на то что у многих больных пульс и артериальное давление остаются в пределах нормы, примерно у 25 % больных с передним инфарктом миокарда наблюдают проявления гиперреактивности симпатической нервной системы (тахикардия и/или гипертония), а почти у 50 % больных с нижним инфарктом миокарда наблюдают признаки повышенного тонуса симпатической нервной системы (брадикардия и/или гипотония) .
Прекардиальная область обычно не изменена. Пальпация верхушечного толчка может быть затруднена. Почти у 25 % больных с передним инфарктом миокарда в течение первых дней болезни в периапикальной области выявляется измененная систолическая пульсация, которая вскоре может исчезнуть. Другие физикальные признаки дисфункции левого желудочка, которые могут встречаться при остром инфаркте миокарда, в порядке убывания по частоте встречаемости располагаются следующим образом: IV (S4) или III (S3) сердечные тоны, приглушенность тонов сердца и, редко, парадоксальное расщепление II тона (гл. 177).
Преходящий систолический шум на верхушке сердца, возникающий преимущественно как следствие вторичной недостаточности левого предсердно-желудочкового клапана (митральной недостаточности) из-за дисфункции сосочковых мышц, имеет средне- или позднесистолический характер. При выслушивании у многих больных с трансмуральным инфарктом миокарда временами прослушивается шум трения перикарда. У больных с инфарктом правого желудочка часто возникает пульсация растянутых яремных вен, отмечается уменьшение объема пульса на каротидных артериях, несмотря на нормальный сердечный выброс. В 1-ю неделю острого инфаркта миокарда возможен .подъем температуры тела до 38 °С, но, если температура тела превышает 38 °С, следует искать другие причины ее повышения. Величина артериального давления варьирует в широких пределах. У большинства больных с трансмуральным инфарктом миокарда систолическое артериальное давление снижается на 10-15 мм рт. ст. от исходного уровня.
Инфаркт миокарда : Лабораторные исследования
Для подтверждения диагноза инфаркта миокарда служат следующие лабораторные показатели:
1) неспецифнческие показатели тканевого некроза и воспалительной реакции;
2) данные электрокардиограммы;
3) результаты изменения уровня ферментов сыворотки крови.
Проявлением неспецифической реактивности организма в ответ на повреждение миокарда является полиморфно-клеточный лейкоцитоз, который возникает в течение нескольких часов после появления ангинозной боли, сохраняется в течение 3-7 сут и часто достигает значений 12-15o109/л. СОЭ повышается не так быстро, как число лейкоцитов в крови, достигает пика в течение 1-й недели и иногда остается повышенной 1-2 нед.
Электрокардиографические проявления острого инфаркта миокарда подробно описаны в разделе по электрокардиографии. Хотя не всегда имеется четкая связь между изменениями на ЭКГ и степенью повреждения миокарда, однако появление патологического зубца Q или исчезновение зубца R обычно позволяет с большой вероятностью диагностировать трансмуральный инфаркт миокарда. О наличии нетрансмурального инфаркта миокарда говорят в тех случаях, когда на ЭКГ выявляются лишь транзиторные изменения сегмента ST и стойкие изменения зубца Т. Однако эти изменения весьма вариабельны и неспецифичны и поэтому не могут служить основой для диагностики острого инфаркта миокарда. В этой связи рациональная номенклатура для диагностики острого инфаркта миокарда должна лишь разграничивать последний на трансмуральный и нетрансмуральный в зависимости от наличия изменений зубца Q или волн ST-Т.
Инфаркт миокарда : Сывороточные ферменты
Некротизированная во время острого инфаркта миокарда сердечная мышца выделяет в кровь большое количество ферментов. Скорость выброса различных специфических ферментов неодинакова. Изменение уровня ферментов в крови во времени имеет большую диагностическую ценность. Динамика концентрации ферментов, наиболее часто используемых для диагностики острого инфаркта миокарда, показана на рис. 190-1. Уровень двух ферментов, сывороточной глутаматоксалоацетаттрансаминазы (СГОТ) и креатинфосфокиназы (КФК) возрастает и снижается очень быстро, в то время как уровень лактатдегидрогеназы (ЛДГ) нарастает медленнее и дольше остается повышенным. Недостаток определения СГОТ заключается в том, что этот фермент содержится также в скелетных мышцах, в клетках печени, эритроцитах и может высвобождаться из этих экстракардиальных источников.
Поэтому в настоящее время определение СГОТ для диагностики острого инфаркта миокарда используют реже, чем раньше, вследствие неспецифичности этого фермента и того, что динамика его концентрации занимает промежуточное положение между динамикой концентрации КФК и динамикой концентрации ЛДГ, в связи с чем информация об уровне СГОТ становится в большинстве случаев излишней. Определение содержания MB изофермента КФК имеет преимущества перед определением концентрации СГОТ, поскольку этот изофермент практически не определяется в экстракардиальной ткани и поэтому более специфичен, чем СГОТ. Поскольку подъем концентрации КФК или СГОТ определяется в течение короткого времени, он может оставаться незамеченным в тех случаях, когда образцы крови берут более чем через 48 ч после развития инфаркта миокарда. Определение MB-КФК имеет практический смысл в тех случаях, когда есть подозрение на повреждение скелетных мышц или ткани мозга, поскольку в них содержатся значительные количества этого фермента, но не его изофермента. Специфичность MB-изофермента для определения повреждения миокарда зависит от используемой методики. Наиболее специфичен радиоиммуноанализ, однако на практике тем не менее чаще используют электрофорез в геле, обладающий меньшей специфичностью и поэтому чаще дающий ложноположительные результаты. При остром инфаркте миокарда уровень ЛДГ повышается в первый же день, между 3-м и 4-м днем он достигает пика и в среднем через 14 дней возвращается к норме. При проведении электрофореза в крахмальном геле можно выделить пять изоферментов ЛДГ. Разные ткани содержат различные количества этих изоферментов. Изофермент, обладающий наибольшей электрофоретической подвижностью, в основном содержится в миокарде, его обозначают как ЛДГ). Изоферменты, обладающие наименьшей электрофоретической подвижностью, содержатся преимущественно в скелетной мускулатуре и в клетках печени. При остром инфаркте миокарда уровень ЛДГ1 повышается еще до того, как повышается уровень общей ЛДГ, т. е. может наблюдаться повышение содержания ЛДГ) при нормальном содержании общей ЛДГ. Следовательно, выявление повышенного уровня ЛДГ| является более чувствительным диагностическим тестом при остром инфаркте миокарда, чем уровень общей ЛДГ, его чувствительность превышает 95 %.
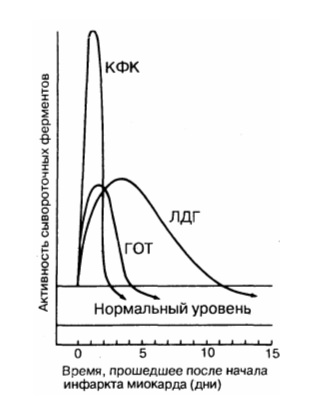 Рис. 190-1. Динамика сывороточных ферментов после типичного инфаркта миокарда. КФК – креатинфосфокиназа; ЛДГ – лактатдегидрогеназа; ГОТ – глутаматрксалоацетаттрансаминаза.
Рис. 190-1. Динамика сывороточных ферментов после типичного инфаркта миокарда. КФК – креатинфосфокиназа; ЛДГ – лактатдегидрогеназа; ГОТ – глутаматрксалоацетаттрансаминаза.
Особую клиническую значимость представляет тот факт, что увеличенный в 2-3 раза уровень общей КФК (но не MB-КФК) может быть следствием внутримышечной инъекции. Возможны случаи парадоксальной диагностики острого инфаркта миокарда у больных, которым была сделана внутримышечная инъекция наркотика в связи с болями в грудной клетке, не связанными с патологией сердца. Кроме того, потенциальными источниками повышенного уровня КФК могут быть: 1) заболевания мышц, в том числе мышечные дистрофии, миопатии, полимиозиты; 2) электроимпульсная терапия (кардиоверсия); 3) катетеризация сердца; 4) гипотиреоидизм; 5) инсульт мозга; 6) хирургические вмешательства; 7) повреждения скелетных мышц при травмах, конвульсиях, длительной иммобилизации. Хирургические вмешательства на сердце и электроимпульсная терапия часто могут приводить к повышению уровня изофермента КФК.
Известно, что существует корреляция между количеством выброшенного в кровь фермента и размером инфаркта миокарда. Продемонстрировано, что масса миокарда, подвергшегося некрозу, может быть определена по кривой концентрация – время в том случае, если известны кинетика высвобождения фермента, его распада, распределения и пр. Анализ кривой концентрация – время для MB – КФК позволяет определить величину инфаркта миокарда в граммах. В то время как площадь под кривой изменения концентрации MB – КФК во времени отражает размеры инфаркта миокарда, абсолютные значения концентрации этого фермента и время до достижения максимума концентрации связаны с кинетикой вымывания MB – КФК из миокарда. Появление просвета в окклюзированной венечной артерии, происходящее либо спонтанно, либо под влиянием механического воздействия или фармакологических препаратов в ранние сроки острого инфаркта миокарда, вызывает быстрый рост концентрации фермента.
Пик концентрации достигается через 1-3 ч после реперфузии. Общая площадь под кривой "концентрация – время" при этом может быть меньше, чем без реперфузии, что отражает меньшие размеры инфаркта миокарда.
Характерное возрастание концентрации ферментов наблюдается более чем у у 95 % больных с клинически доказанным инфарктом миокарда. При нестабильной стенокардии содержание КФК, ЛДГ, СГОТ обычно не повышается. У многих больных с подозрением на инфаркт миокарда исходный уровень ферментов в крови сохраняется в пределах нормы, при инфаркте миокарда он может повышаться в 3 раза, однако при этом он не превышает верхней границы нормы. Такую ситуацию наблюдают у больных с небольшим инфарктом миокарда. Хотя такое повышение содержания фермента нельзя рассматривать как строгий диагностический критерий острого инфаркта миокарда, оно с высокой вероятностью заставляет подозревать его. Практическую помощь в такой ситуации может оказать определение изоферментов.
Для диагностики острого инфаркта миокарда или оценки его тяжести могут оказаться полезными радионуклидные методы. Сцинтиграфию в острой фазе острого инфаркта миокарда (изображение "горячего пятна") выполняют с 99m’Тс-пирофосфатом, содержащим двухвалентное олово. Сканограммы обычно дают положительный результат со 2-го по 5-й день после начала инфаркта миокарда, чаще у больных с трансмуральным инфарктом миокарда. Несмотря на то что метод дает возможность определить локализацию инфаркта миокарда и его размеры (с. 887), в плане диагностики он менее точен, чем определение содержания КФК. Изображения миокарда с помощью таллия-201, который захватывается и концентрируется жизнеспособным миокардом, выявляет дефект перфузии ("холодное пятно") у большинства больных в первые часы после развития трансмурального инфаркта миокарда.
Эта локализованная область. сниженной радиоактивности может заполняться в течение последующих часов. Тем не менее дифференцировать острый инфаркт от старых Рубцовых изменений с помощью данного метода невозможно. Таким образом, сканирование таллием – весьма чувствительный метод для выявления инфаркта миокарда, однако оно неспецифично для острого инфаркта миокарда. Применяя радионуклидную вентрикулографию с эритроцитами, меченными 99mТе, у больных с острым инфарктом миокарда можно выявлять нарушения сократимости и снижение фракции выброса левого желудочка. Радионуклидная вентрикулография весьма ценна при оценке нарушенной гемодинамики при остром инфаркте миокарда и при необходимости установления диагноза инфаркта миокарда правого желудочка, когда снижается фракция выброса правого желудочка. Однако в целом специфичность этого метода низка, поскольку измененные радионуклидные вентрикулограммы регистрируют не только при остром инфаркте миокарда, но и при других патологических состояниях сердца.
В оценке состояния больных острым инфарктом миокарда может оказаться полезной также двухмерная эхокардиография. При этом можно легко выявить нарушения сократимости, в особенности в области перегородки и задненижней стенки. И хотя с помощью эхокардиографии нельзя дифференцировать острый инфаркт миокарда от нарушений сократимости вследствие наличия рубцов или выраженной острой ишемии миокарда, простота и безопасность этого метода позволяют рассматривать его как важный этап обследования больных с острым инфарктом миокарда. Кроме того, эхокардиография может быть весьма информативной для диагностики инфаркта миокарда правого желудочка, аневризмы левого желудочка и тромба в области левого желудочка.







